Preventie
De moderne geneeskunde begint meer en meer een preventieve geneeskunde te worden. Ook inzake borstkanker is hier de laatste jaren, met de ontdekking van het BRCA-gen, een shift gekomen naar preventie. Ondertussen zijn meerdere genen ontdekt alsook meerdere risicofactoren beschreven. Afhankelijk van beide kan een gepersonaliseerde screeningsstrategie gekozen worden. Het is daarom belangrijk om deze risico- en genetische factoren te begrijpen.
Diagnose
Ik kreeg de diagnose kanker... Deze website is een portaal die u en uw naasten zal helpen om persoonlijke informatie en antwoorden te vinden voor uw probleem.
Deze website moet een houvast en steun zijn voor patiënten op weg naar herstel en een beter leven.
Het "Diagnose" gedeelte van onze website is opgesteld in twee belangrijke delen. Ten eerste zorgen we in "Anatomie en Fysiologie" voor een basiskennis van de borst. In het tweede deel "Tumoren en aandoeningen" gaan we dieper in op alles wat met aandoeningen van de borst te maken heeft.
Verder wensen wij vrouwen te informeren die zich afvragen of zij wel een borstprobleem hebben, maar daarvoor nog niet onmiddellijk hun arts willen consulteren. Kennis en informatie kunnen dikwijls een onmiddellijke geruststelling betekenen indien de vrouw zelf in staat is het probleem te onderkennen en inziet dat hier geen specifieke behandeling voor noodzakelijk is. Anderzijds trachten we ook vrouwen te informeren bij wie wel degelijk een ernstig borstprobleem is vastgesteld, zoals bijvoorbeeld een kwaadaardige aandoening, en die goed voorbereid naar hun arts willen stappen.
Behandeling
Bij de behandeling van een borstkanker hoort meteen ook een keuze gemaakt te worden rondom de reconstructie. Er is geen fundamenteler doel van onze Stichting dan deze awareness bij de patiënten en oncologische chirurgen te brengen. Door vooraf een geïnformeerde beslissing te nemen, blazen we geen bruggen op voor een latere reconstructie zonder hierbij het oncologische aspect uit het oog te verliezen. Uiteraard primeert de overleving en zal de beslissing van de oncologische chirurg altijd voorgaan.
Op de pagina "Beslissen" staat alle informatie die u kan verwachten tijdens een eerste consultatie alvorens u de tumor laat verwijderen. Deze pagina is zeer uitgebreid en uw plastisch chirurg zal enkel die informatie vermelden die voor uw persoonlijke situatie toepasbaar is.
"Verwijderen van de tumor" vertelt het verhaal van de operatie zelf. Dit is de belangrijkste operatie want een goede wegname van de tumor is en blijft het belangrijkste. We leiden u door de verschillende vormen van wegname. Deze beslissing wordt vaak voor u genomen door een multidisciplinair team van oncologen, radiologen, pathologen, radiotherapeuten, borstverpleegkundigen, gynaecologen, oncologische chirurgen en plastische chirurgen.
In het deel "Borstreconstructie" staat alle informatie en illustratie van de verschillende soorten reconstructie met bijhorende stappen.
Revalidatie
Wie behandeld is voor kanker heeft vaak een lange periode nodig om te herstellen.
Kanker is een ingrijpende ziekte met een zware behandeling. Vaak kampen mensen nadien met psychosociale en/of lichamelijke problemen zoals stress, angst, extreme vermoeidheid, pijnlijke gewrichten, een verminderde conditie, lymfoedeem… Dit kan een grote invloed hebben op het algemeen welzijn.
Er zijn revalidatieprogramma’s die worden aangeboden door de meeste ziekenhuizen. We behandelen hier een aantal grote thema’s.
Quality of life
De levenskwaliteit is een belangrijke factor bij het omgaan met borstkanker. Daarom is het belangrijk om coping-mechanismen te vinden die werken, en die zullen van patiënt tot patiënt verschillen. Voor sommigen kan dat zijn: plezier vinden in activiteiten die zij voor de diagnose deden, tijd nemen om te genieten, vrijwilligerswerk doen, lichaamsbeweging... Van het grootste belang is dat studies hebben aangetoond dat het accepteren van de ziekte als een deel van iemands leven een sleutel is tot effectieve verwerking, evenals het focussen op mentale kracht om de patiënt in staat te stellen verder te gaan met het leven. In dit gedeelte behandelen we enkele onderwerpen die patiënten tijdens en na de behandeling ervaren en geven we informatie om deze aan te pakken.
Genetische factoren
Familiale voorgeschiedenis als risico factor
Een belaste familiale voorgeschiedenis is één van de sterkste indicatoren voor een groter risico op het ontwikkelen van borstkanker. Naarmate er in een familie meer vrouwen met borstkanker werden gediagnosticeerd, ze nauwer verwant zijn met elkaar en de leeftijd bij diagnose lager is, is het risico bij andere vrouwen uit die familie om zelf borstkanker te ontwikkelen groter.
We schatten dat ongeveer 20 tot 30% van alle borstkankerpatiënten minstens één verwante met dezelfde aandoening hebben, bij ongeveer 5 tot 10% van alle patiënten is er een sterke genetische voorbeschiktheid.
Volgende elementen zijn bepalend in het risico dat een vrouw heeft om zelf borstkanker te ontwikkelen:
het aantal verwanten dat borst- of eierstokkanker ontwikkelde in haar familie,
de verhouding van het aantal aangetaste tot het aantal niet-aangetaste vrouwen,
de graad van verwantschap tussen aangetaste individuen,
de leeftijd waarop borstkanker werd vastgesteld bij haar verwanten,
het optreden van borstkanker in beide borsten (bilateraal borstcarcinoom) bij een verwante,
het optreden van eierstokkanker in de familie en
het optreden van borstkanker bij mannen.
Deze elementen vormen het uitgangspunt om aan patiënten een sterk, matig of licht verhoogd risico toekennen. Op basis van dit risico wordt in eerste instantie advies gegeven m.b. t. het optimale screeningsbeleid.
Naast informatie over het borstkankerrisico gebruiken we de familiale gegevens eveneens om families te identificeren waarin het opstarten van erfelijkheidsonderzoek zinvol kan zijn. De criteria die we hiervoor hanteren zijn weergegeven in tabel 1. Deze criteria worden eerder gebruikt als leidraad: soms wordt het onderzoek ook in families die niet aan deze criteria voldoen, gestart als daar specifieke redenen voor zijn. Deze kunnen bijvoorbeeld zijn: een moeilijk te beoordelen stamboom (omwille van een kleine familie of omdat er veel mannelijke verwanten zijn) of als erfelijkheidsonderzoek belangrijke klinische implicaties heeft. Uitzondering wordt ook soms gemaakt voor patiënten met sterk verhoogde angstigheid voor wie een genetische test een bijna vitaal karakter krijgt.
Tabel 1. Inclusiecriteria voor moleculair genetisch onderzoek van BRCA1 en BRCA2, zoals die meestal gehanteerd worden:
families met drie eerstegraadsverwanten* met borst- en/of ovariumcarcinoom
families met tenminste twee eerste- en/of tweedegraadsverwanten** met borst en/of ovariumcarcinoom vastgesteld op een gemiddelde leeftijd jonger dan 50 jaar.
alle patiënten die borst- en/of ovariumkanker ontwikkelden voor de leeftijd van 35 jaar.
personen bij wie een mutatie in de familie werd aangetoond.
mannelijke patiënten met een borstcarcinoom.
* eerstegraadsverwanten: moeder en dochter, zussen
** tweedegraadsverwanten: grootmoeder en kleinkind, tante en nicht
Familiale en erfelijke vormen van borstkanker
Vrouwen met een sterk verhoogd risico op borstkanker hebben typisch meerdere eerstegraadsverwanten bij wie borstkanker op jonge leeftijd werd vastgesteld of hebben één of meerdere verwanten met multifocaal of bilateraal borstkanker. De familiale anamnese bij deze vrouwen is bovendien vaak positief voor eierstokkanker of ovariumcarcinoom en soms worden ook mannelijke verwanten in deze families met borstkanker gediagnosticeerd. Het is in deze families dat de genetische voorbeschiktheid vaak het gevolg is van het overerven van een genetische afwijking, ook mutatie genoemd, in het BRCA1 of BRCA2 gen. Dergelijke families voldoen meestal aan de criteria van wat we het hereditair of erfelijk borst- en ovariumcarcinoom syndroom noemen.
Tabel: Familiale borstcarcinoom en het hereditair borst- en ovariumcarcinoom syndroom. | |
|
|
| borstkanker bij minstens 2 eerste- of tweedegraadsverwantes, op jonge leeftijd, zonder dat de voorwaarden voor de hereditaire vorm voldaan zijn |
In families waarin het risico matig of licht verhoogd is, is de verwantschap tussen aangetaste verwanten minder sterk en ligt de leeftijd bij diagnose een stuk hoger. Deze families identificeren we meestal als familiaal borstcarcinoom (tabel 2). In een minderheid van deze families kunnen ook genetische afwijkingen in BRCA1 of BRCA2 aangetoond worden. Er zijn aanwijzingen dat in deze families ook andere genetische ‘varianten’ een rol kunnen spelen. Dit zijn afwijkingen in het erfelijk materiaal die het risico op het ontwikkelen van borstkanker bij een persoon minder sterk beïnvloeden dan de mutaties in BRCA1 of BRCA2. Deze varianten komen waarschijnlijk veel frequenter voor dan BRCA1 of BRCA2 mutaties en kunnen dus een groter effect hebben in de algemene bevolking. Bovendien is de kans reëel dat de impact van deze varianten kan beïnvloed worden door niet-genetische factoren. Voorlopig is het echter niet mogelijk voor deze varianten moleculair genetisch onderzoek routinematig aan te beiden. Voor het bepalen van het risico op niet-aangetaste verwanten in deze families moeten we dus terugvallen op een analyse van de stamboom.
Het onderscheid tussen erfelijk en familiaal borstcarcinoom is niet scherp te stellen. De bijdrage van genetische afwijkingen moet waarschijnlijk beschouwd worden als een soort continuüm: in familiaal borstkanker spelen eerder genetische afwijkingen een rol die het risico op borstcarcinoom discreet beïnvloeden, terwijl in monogenische vormen in de meerderheid van de families BRCA1 en BRCA2 mutaties aanwezig zijn die het risico sterk beïnvloeden, zie Figuur 1. Een groot aantal families bevindt zich echter op de grens tussen beide entiteiten en in een aantal ervan kunnen we BRCA1 of BRCA2 mutaties aantonen.
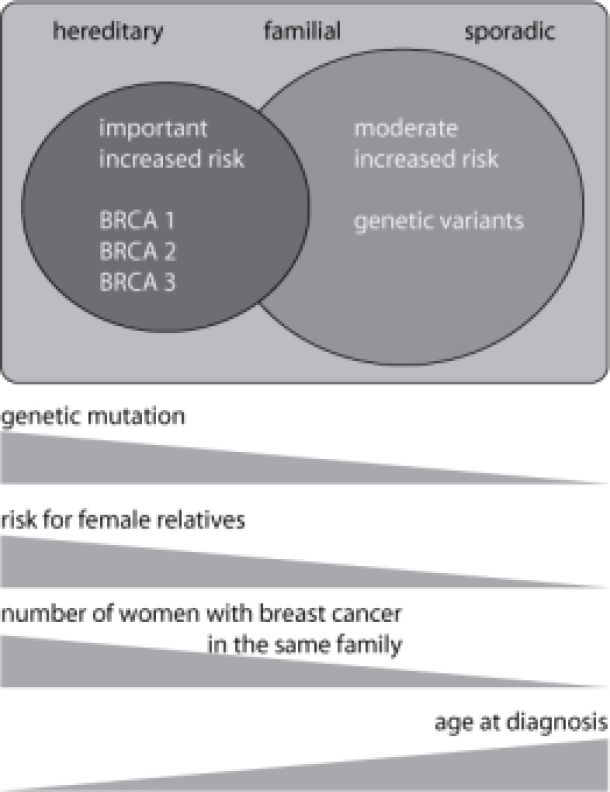
Figuur: Borstkanker en de familiale voorgeschiedenis ervoor laten toe patiënten onder te verdelen in drie overlappende klassen: de sporadische, familiale en erfelijke vormen. Genetische afwijkingen (mutaties in BRCA1 en BRCA2) kunnen meest frequent aangetoond worden in de erfelijke vorm. Deze genetische afwijkingen veroorzaken een sterk verhoogd risico op borst- en eierstokkanker bij vrouwelijke draagsters. In familiaal borstcarcinoom is er waarschijnlijk een rol voor genetische varianten die het risico minder sterk beïnvloeden. Naarmate de leeftijd bij diagnose lager ligt en het aantal aangetaste verwanten in een familie hoger, wordt de kans op een erfelijke vorm groter. Dit houdt eveneens in dat het risico voor andere vrouwen uit de familie om zelf ook borstkanker te ontwikkelen eveneens sterk stijgt.
BRCA1, BRCA2 en erfelijkheid van borst- en eierstokkanker
Om de erfelijkheid van borstkanker beter te begrijpen bespreken we hier kort enkele begrippen uit de erfelijkheidsleer.
Onze genetische informatie zit vervat in afzonderlijke pakketjes, chromosomen genoemd. De 46 chromosomen komen voor in paren, 22 autosomen en één paar geslachtschromosomen. Van elk paar erfden we één exemplaar onze vader, het andere van onze moeder. Een chromosoom bestaat uit één enkele lange DNA molecule waarin de genetische of erfelijke code is vervat. Een DNA fragment dat functioneel belangrijk is en codeert voor een eiwit, noemen we een gen. De informatie op elk chromosoom is gelijkaardig, zo hebben we van elk gen twee kopijen.
BRCA1 en BRCA2 zijn genen die normaal bescherming bieden tegen het ontwikkelen van kanker. Wanneer bij een individu één van beide genen een fout of mutatie bevat, kan de kans dat die persoon kanker ontwikkelt sterk verhoogd zijn. Genetische afwijkingen in BRCA1 en BRCA2 kunnen bovendien overerfbaar zijn. De kans dat een drager of draagster van zo een mutatie deze doorgeeft aan zijn of haar kinderen is 50%.
Vrouwelijke draagsters van een BRCA1 of BRCA2 mutatie hebben een belangrijk risico op het ontwikkelen van borst- en eierstokkanker, zie tabel 3. Voor BRCA1 en BRCA2 mutatie-draagsters is het risico op borstkanker waarschijnlijk even hoog en kan oplopen tot meer dan 80%. Het risico op het ontwikkelen van ovariumcarcinoom is duidelijk groter bij draagsters van een BRCA1 mutatie. Het risico op kanker is waarschijnlijk eveneens verhoogd voor mannelijke dragers, zij het in veel mindere mate. In tegenstelling tot vrouwelijke draagsters lijkt vooral dragerschap van een BRCA2 mutatie verbonden aan een hoger risico op het ontwikkelen van kanker bij mannen. De bijzonder hoge risico’s geassocieerd aan dragerschap van een BRCA1 of BRCA2 mutatie en het overervingspatroon zorgen ervoor dat we families waarin zo een mutatie overerft kunnen herkennen aan: het frequent optreden van borstkanker op jonge leeftijd, het voorkomen van borst- en eierstokkanker in eenzelfde familie, het vaststellen van bilateraal borstkanker bij één of meerdere verwantes en het ontstaan van borstkanker bij mannen. Niet toevallig zijn dit eveneens de criteria die we gebruiken om hoogrisico families te identificeren.
Tabel: Risico's verbonden aan dragerschap van een BRCA1 of BRCA2 mutatie.* | ||
Vrouwelijke draagsters | ||
BRCA 1 | BRCA 2 | |
Borstkanker | 85% | 86% |
Contralateraal borstkanker** | 60% | 55% |
Eierstokkanker | 63% | 27% |
Mannelijke dragers | ||
BRCA 1 | BRCA 2 | |
Borstkanker | mogelijks verhoogd | 7% |
Darmkanker | mogelijks verhoogd | mogelijk verhoogd |
Prostaatkanker | 33% | 34% |
Melanoom | - | 5% |
* de risico’s weergegeven in de tabel zijn afgeleid uit studies van families met BRCA1 en BRCA2 mutaties die de sterkste stijging van het risico veroorzaken, daarom moeten deze risico’s als maximumwaarde gezien worden.
** het voorkomen van borstkanker in de andere borst bij een vrouw die al borstkanker ontwikkeld heeft
Patiënten stellen zich vaak de vraag of ze niet de eerste kunnen zijn bij wie een mutatie is ontstaan. Dit fenomeen, het optreden van nieuwe mutaties in BRCA1 of BRCA2, gebeurt extreem zelden: bijna steeds is de mutatie overgeërfd. Dit verklaart waarom een sterk belaste familiale voorgeschiedenis nog steeds het sterkste argument vormt voor de aanwezigheid van een BRCA1 of BRCA2 mutatie en dus de erfelijkheid voor borst- of eierstokkanker. Dit fenomeen vormt ook een verklaring waarom bij patiënten zonder familiale belasting, zelfs indien ze bijzonder jong zijn op het tijdstip van diagnose, vrijwel nooit een mutatie gedetecteerd wordt.
Mutaties in BRCA1 en BRCA2 komen voor over de volledige lengte van het gen, er zijn geen zogenaamde ‘hot-spot’ mutaties of frequent terugkerende mutaties. Aangezien beide genen bovendien ook bijzonder groot zijn, is het moleculair genetisch onderzoek zeer tijdsrovend en arbeidsintensief en neemt per patiënt een zestal maanden in beslag. De complexiteit van beide genen heeft ook een negatieve invloed op de gevoeligheid van het moleculair onderzoek. De gevoeligheid van het onderzoek is bovendien afhankelijk van het soort mutaties dat in een bepaalde bevolking voorkomt. Niet alle mutatievormen kunnen namelijk door één bepaalde techniek opgespoord worden. Ondanks het feit dat beide genen volledig onderzocht worden met verschillende technieken, moet in het advies dus steeds rekening gehouden worden met een vals negatief resultaat: de mogelijkheid dat een genetische afwijking in BRCA1 of BRCA2 met het toegepaste onderzoek werd gemist.
Preventieve strategieën
Geconfronteerd met de bijzonder hoge risico’s op het ontwikkelen van kanker zijn er een aantal preventieve maatregelen die vrouwelijke draagsters kunnen overwegen (zie tabel).
Een eerste optie bestaat uit het op regelmatige tijdstippen uitvoeren van controle-onderzoeken of intensieve screening. Het doel hiervan is borst- of eierstokkanker in een vroegtijdig stadium vast te stellen zodat de kans op genezing maximaal wordt.
Intensieve screening kan evenwel het ontstaan van kanker niet verhinderen. Daarom opteren sommige vrouwen voor het preventief verwijderen van het weefsel waarin kanker kan ontstaan: preventieve borstamputatie of mastectomie en het preventief verwijderen van de eierstokken en eileiders of wat men een preventieve bilaterale salpingo-ovariëctomie (BSO) noemt. Deze preventieve operaties bleken bijzonder krachtig in het verlagen van het risico op het ontwikkelen van borst- en eierstokkanker, al reduceren ze het risico op het ontwikkelen van kanker niet volledig. Een belangrijk voordeel van de preventieve BSO is dat door deze ingreep ook het risico op het ontwikkelen van borstkanker met ongeveer de helft wordt verlaagd.
Een laatste mogelijkheid voor preventie is het toedienen van medicatie om het risico op het ontwikkelen van kanker te verlagen, de zogenaamde chemoprofylaxie. Momenteel zijn er nog bijzonder weinig studies die het nut van chemoprofylaxie bij BRCA1 of BRCA2 mutatie-draagsters hebben nagegaan en daarom is deze optie nog relatief controversieel. Enkel bij vrouwen die reeds borstkanker ontwikkeld hebben weten we dat een nabehandeling met tamoxifen het risico op het ontwikkelen van een nieuwe borsttumor met ongeveer de helft verlaagde. Mogelijks kan chemoprofylaxie naar de toekomst ook voor asymptomatische mutatie-draagsters eveneens een oplossing bieden.
Het maken van een keuze tussen de verschillende preventieve strategieën is een bijzonder complex proces waarin zowel medische als persoonlijke elementen belangrijk zijn. Vooreerst spelen in deze keuze uiteenlopende facetten uit het leven van de patiënte een rol. Belangrijke elementen hierin zijn: de beleving van het risico om ooit kanker te krijgen, de kinderwens, seksualiteit en relatie, het vrouw-zijn en de ervaringen met kanker in de familie. De keuze wordt verder bemoeilijkt door een aantal medische punten die momenteel onderwerp zijn van discussie. Zo is het actueel onduidelijk wat het beste interval en de optimale frequentie van screening zijn, zowel voor borst- als voor eierstokkanker. Hoewel we verwachten dat met nucleaire magnetische resonantie (NMR) borstkanker in meer vroegtijdig stadium kan worden gedetecteerd is de plaats van NMR in de screening bij BRCA1 en BRCA2 draagsters nog niet helemaal duidelijk. Verder zijn nog onvoldoende data beschikbaar die het effect op levensverwachting van de verschillende preventieve strategieën aantonen. Hoewel het bijvoorbeeld is aangetoond dat preventieve heelkunde het risico op het ontwikkelen van kanker kan verkleinen is het momenteel niet bekend of dit, in vergelijking met intensieve screening, ook werkelijk resulteert in een betere overleving. Ook zijn de effecten van tijdelijke hormonale substitutie na een preventief verwijderen van de eierstokken onduidelijk, de vrees bestaat namelijk dat dit het risico op het ontwikkelen van borstkanker opnieuw zou verhogen.
Het is duidelijk dat tussen de verschillende opties er geen ‘beste’ keuze bestaat. Het is voornamelijk belangrijk dat voor iedere patiënte een oplossing gevonden wordt waarbij ze zich beschermd voelt tegen het risico dat kanker voor haar vormt en die haar voldoende levenskwaliteit garandeert. Voor sommige vrouwen is preventieve heelkunde de beste oplossing om om te gaan met het risico dat ze hebben op borst- of eierstokkanker, terwijl anderen eerder een sterk vertrouwen hebben in medische opvolging. Vaak kan het contact met lotgenoten belangrijk zijn in het uitwisselen van ervaringen rond deze problematiek.
Voor mannelijke dragers van een BRCA1 of BRCA2 mutatie wordt voornamelijk screening aangeraden voor het vroegtijdig diagnosticeren van darm- en prostaatkanker en huidtumoren (zie tabel).
Tabel: mogelijke preventieve strategieën bij dragers en draagsters van een BRCA1 of BRCA2 mutatie | ||
Vrouwelijke draagsters | ||
Borstkanker | Screening | maandelijks zelfonderzoek vanaf jonge leeftijd |
3- tot 6-maandelijks klinisch onderzoek door een arts vanaf 20 jaar | ||
jaarlijkse echo-en mammografie, eventueel aangevuld met MRI vanaf 25 jaar | ||
Preventieve heelkunde | preventieve mastectomie | |
preventieve bilaterale salpingo-ovariëctomie | ||
Chemoprofylaxie | tamoxifen (momenteel vooral bij vrouwen die reeds borstkanker ontwikkelden) | |
Eierstokkanker | Screening | 6-maandelijks klinisch-gynaecologisch onderzoek vanaf 35 jaar |
6-maandelijkse transvaginale echografie, vanaf 35 jaar | ||
6-maandelijks CA-125 dosering in het bloed, vanaf 35 jaar | ||
Preventieve heelkunde | preventieve bilaterale salpingo-ovariëctomie | |
Chemoprofylaxie | (mogelijks protectief van hormonale contraceptiva) | |
Mannelijke dragers | ||
Borstkanker | Screening | geen uniforme richtlijn |
Darmkanker | Screening | coloscopie, vanaf 50 jaar |
Prostaatkanker | Screening | rectaal prostaatonderzoek en echografie vanaf 40 jaar |
PSA-dosering vanaf 40 jaar | ||
Melanoom | Screening | jaarlijkse inspectie van de huid (in principe enkel voor BRCA2 mutatie-dragers) |
Het CHEK-2 gen
Naast de BRCA-mutaties bestaan ook mutaties in andere genen die ons beschermen tegen de ontwikkeling van kanker. Gewoonlijk hebben deze mutaties een lagere penetrantie, dat wil zeggen dat de kans dat men door deze mutatie kanker ontwikkelt, kleiner is. Een van de meest bestudeerde mutaties na de BRCA-mutaties, is het CHEK2-gen. Het CHEK2-gen bevindt zich op chromosoom 22, en staat normaal in voor de vorming van een eiwit dat tussenkomt in het herstel van beschadigd DNA. Een mutatie in dit gen geeft daarom een tweemaal verhoogd risico op borstkanker. Als deze mutatie echter voorkomt in zowel het gen dat van de vader als van de moeder is overgeërfd, dan stijgt het risico op borstkanker tot 6 maal. De mutatie komt vooral voor in Noord-Europa (Finland, Nederland), waar 3% van de mensen drager zijn. Ze is veel zeldzamer in Zuid-Europa (0.5%) Hoewel de mutatie zeldzamer is dan de BRCA-mutaties en een kleiner risico op borstkanker met zich meedraagt, wordt ze tegenwoordig toch beschouwd als de derde belangrijkste genetische risicofactor voor borstkanker.
Referenties
Apostolou P1, Fostira F. Hereditary breast cancer: the era of new susceptibility genes.. Biomed Res Int. 2013;747318. doi: 10.1155/2013/
D. Easton. CHEK2 ∗1100delC and susceptibility to breast cancer: a collaborative analysis involving 10,860 breast cancer cases and 9,065 controls from 10 studies,” The American Journal of Human Genetics, 2004;74:1175–1182.
Liu C1, Wang Y, Wang QS, Wang YJ. The CHEK2 I157T variant and breast cancer susceptibility: a systematic review and meta-analysis.. Asian Pac J Cancer Prev. 2012;13:1355-60
S. Narod et al. Estimating survival rates after ovarian cancer among women tested for BRCA1 and BRCA2 mutations. Clinical Genetics 2012; 83:3:232–237
M. Gage, D. Wattendorf, and L. R. Henry. Translational advances regarding hereditary breast cancer syndromes. Journal of Surgical Oncology. 2012;105:5. 444–451
C. Cybulski, B. Gorski, T. Huzarski et al. Effect of CHEK2 missense variant 1157T on the risk of breast cancer in carriers of other CHEK2 or BRCA1 mutations,” Journal ofMedical Genetics 2009; 46:132–135.
Genetisch advies voor borstkanker in de praktijk
De evaluatie van de zinvolheid van een erfelijkheidsonderzoek is in eerste instantie gebaseerd op een analyse van de familiale voorgeschiedenis van de patiënte. Zoals vermeld worden de in tabel 1 weergegeven criteria oriënterend gebruikt. Op basis van de familiale voorgeschiedenis wordt niet alleen een indicatie gesteld voor het starten van moleculair onderzoek maar wordt ook een inschatting gemaakt van het risico op borstkanker voor andere vrouwen uit de familie. Dit laatste is voornamelijk belangrijk in het geval het erfelijkheidsonderzoek geen mutatie kan aantonen.
Indien in een familie een vermoeden van erfelijkheid bestaat, kan erfelijkheidsonderzoek of ook mutatie-analyse opgestart worden. Mutatie-analyse wordt in eerste instantie aangeboden aan een persoon die reeds borst- of eierstokkanker ontwikkelde. Moleculair genetisch onderzoek wordt aangeboden aan zoveel mogelijk aangetaste vrouwen in een familie. De reden hiervoor is de volgende: in families waarin een BRCA1 of BRCA2 mutatie aanwezig is, is het nog steeds mogelijk dat een vrouw die geen draagster is, toch borst- of eierstokkanker ontwikkelt. Deze persoon ontwikkelde dus kanker zonder erfelijk belast te zijn, de wetenschappelijke benaming voor dit fenomeen is fenokopij.
Als het onderzoek enkel bij deze vrouw zou uitgevoerd worden, zou voor de familie uiteraard een verkeerd besluit getrokken worden. Om deze kans te minimaliseren, worden best alle aangetaste verwanten volledig onderzocht. Het opstarten van een erfelijkheidsonderzoek bij een persoon die al kanker ontwikkelde noemen we een diagnostisch genetisch onderzoek. In dit erfelijkheidsonderzoek gaan we op zoek naar de genetische afwijking in het BRCA1 of BRCA2 gen. Deze zoektocht neemt, ondanks de recente technologische ontwikkelingen een zestal maanden in beslag. Het onderzoek wordt in België terugbetaald.
Indien door een diagnostisch onderzoek een mutatie kan aangetoond worden, kunnen wij bij alle niet-aangetaste verwanten die dit wensen nakijken of zij deze mutatie wel of niet hebben overgeërfd. Dit onderzoek noemen we een predictief of presymptomatisch onderzoek. Op basis van dit presymptomatisch onderzoek kunnen we zekerheid krijgen over het risico op het ontwikkelen van borst- of eierstokkanker: vrouwen die de mutatie niet overerfden hebben het bevolkingsrisico op borst- en eierstokkanker, terwijl bij vrouwen die wél draagster zijn dit risico sterk gestegen is. Uiteraard is het ook zinvol aan mannelijke verwanten dit onderzoek aan te bieden, vermits hun risico op darm- en prostaatkanker gestegen kan zijn en omdat zij de mutatie ook kunnen doorgeven aan hun kinderen. Dit is vanzelfsprekend zeer belangrijk wanneer ze zelf dochters hebben.
Wanneer bij een aangetaste vrouw het diagnostisch onderzoek geen mutatie kan aantonen, kan geen uitspraak gedaan worden over het al dan niet erfelijke karakter van borstkanker in haar familie. Een vals normaal testresultaat is een mogelijke verklaring. De kans bestaat ook dat in haar familie een mutatie in een ander nog niet gekend (en dus niet onderzocht) gen aanwezig is. Voor genetisch advies aan haar niet-aangetaste verwanten moeten wij dan terugvallen op de familiale voorgeschiedenis, het aanbieden van een presymptomatisch onderzoek aan andere verwantes is in dit geval niet mogelijk.
Wanneer in een familie alle vrouwen die borst- of eierstokkanker ontwikkelden overleden zijn, kan presymptomatisch onderzoek overwogen worden bij een niet-aangetaste eerstegraadsverwante. Bij deze vrouwen is de a priori kans op dragerschap echter 50%, zodat een negatief testresultaat als niet informatief moet worden beschouwd. De kans bestaat namelijk dat een BRCA1 of BRCA2 mutatie bij aangetaste verwanten aanwezig was, maar dat die persoon de mutatie niet overerfde. Bovendien bestaat nog steeds de mogelijkheid van een vals negatief resultaat. Indien wél een mutatie gevonden wordt, wordt dragerschap wel met zekerheid bevestigd.
Een belangrijke stap in het opstarten van een erfelijkheidsonderzoek is het bekomen van de geïnformeerde toestemming of het ‘informed consent’ van de patiënte. Gezien het specifieke karakter van een erfelijkheidsonderzoek worden daarom vooraleer het onderzoek te starten een aantal thema’s met de patiënte besproken, zodat ze volledig op de hoogte is van het verloop, de implicaties en de mogelijke testresultaten van het erfelijkheidsonderzoek. Specifieke aandachtspunten zijn weergegeven in de tabel.
Tabel 4. Aandachtspunten bij het bekomen van de geïnformeerde toestemming van de patiënt bij het opstarten van een erfelijkheidsonderzoek.
het recht om niet onderzocht te worden
het doel, de betrouwbaarheid en het verloop van genetisch onderzoek
de kostprijs van het genetisch onderzoek
de implicaties van een normaal genetisch onderzoek of van het aantonen van een genetische afwijking
de mogelijkheid dat geen nuttige informatie bekomen wordt na het voltooien van het onderzoek
de nadelen van genetisch onderzoek
de confidentialiteit van de testresultaten
de mogelijkheid tot discriminatie
het risico op dragerschap bij kinderen
Naast het verstrekken van informatie over het erfelijkheidsonderzoek is er ook toenemende aandacht voor de psychologische begeleiding van patiënten en families bij wie het onderzoek wordt gestart, zowel in diagnostische als in presymptomatische setting. Deze begeleiding heeft voornamelijk als doel op maat van de patiënte en haar omgeving ondersteuning te bieden bij onder andere:
het omgaan met en het verwerken van het testresultaat
het uitwisselen van informatie binnen een familie
het kiezen voor een bepaalde preventieve strategie
de bezorgdheid voor dragerschap bij kinderen of andere verwanten
de impact van het erfelijkheidsonderzoek op de relatie en de kinderwens
Een illustratie
Els komt consulteren uit bezorgdheid wegens het voorkomen van borstkanker in haar familie (figuur). Ze is 27 jaar oud en heeft zelf nooit borstkanker doorgemaakt. Er wordt op de raadpleging een stamboom opgemaakt, waaruit blijkt dat een groot aantal familieleden langs haar vaderskant in de familie borstkanker ontwikkelden: haar tante Linda ontwikkelde borstkanker toen ze 38 jaar was, haar grootmoeder is overleden aan de ziekte op 42-jarige leeftijd. De twee oudste zussen van grootmoeder werden eveneens met borstkanker gediagnosticeerd: de oudste op 65-jarige leeftijd, een andere ontwikkelde bilateraal borstkanker, de eerste maal op 45 jaar de andere keer toen ze 51 jaar was. Twee van de 5 nichten van de vader van Els ontwikkelden eveneens borstkanker op jonge leeftijd.
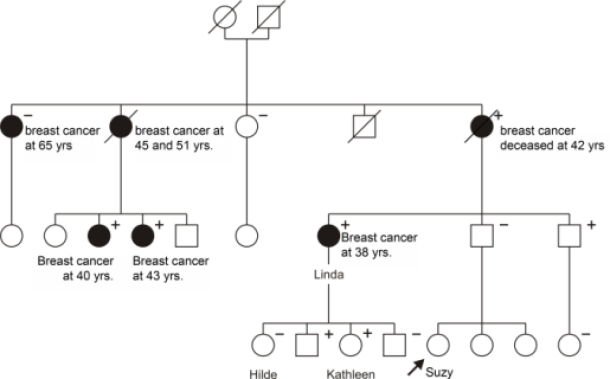
Figuur: Representatieve stamboom van een familie met een erfelijke voorbeschiktheid voor borstkanker. Om redenen van confidentialiteit en anonimiteit is deze stamboom een fictief voorbeeld, gebaseerd op onze ervaringen uit de klinische praktijk. Mannelijke familieleden worden voorgesteld door een vierkant, terwijl vrouwelijke verwantes weergegeven worden door een cirkel. Vrouwen die borst- of eierstokkanker ontwikkelden zijn zwart ingekleurd. Wanneer een persoon overleden is, wordt dit aangeduid door een schuine streep doorheen het symbool.
In deze familie ontwikkelden veel verwantes uit verschillende generaties borstkanker op jonge leeftijd: de kans is dus groot dat erfelijkheid een belangrijke rol speelt in het ontstaan van borstkanker bij deze vrouwen. Een genetische afwijking werd vastgesteld bij Linda in BRCA1 gen. Verder onderzoek toonde dragerschap (aangeduid door een ‘+’ teken) bij verschillende andere verwanten, bij vrouwen die reeds borstkanker ontwikkelden (diagnostisch onderzoek) en bij niet-aangetaste personen (presymptomatisch onderzoek), zowel bij mannen als bij vrouwen. Bij een aantal verwanten bleek de mutatie afwezig, deze individuen werden aangeduid met een ‘-‘ teken. De oudste zus van de moeder van Linda ontwikkelde borstkanker op 65-jarige leeftijd, maar bleek geen draagster van de BRCA1 mutatie, zij vertegenwoordigt wat men noemt een fenokopij.
Els komt tijdens de consultatie te weten dat de kans dat erfelijkheid een rol speelt in het ontstaan van borstkanker in haar familie groot is en dat een erfelijkheidsonderzoek zeker zinvol lijkt. Ze is wel wat verwonderd dat er niet onmiddellijk bij haar bloed afgenomen wordt. De arts vertelt haar dat in een familie waarin een erfelijkheidsonderzoek gestart wordt, dit onderzoek in eerste plaats gestart wordt bij iemand die borstkanker ontwikkeld heeft omdat de kans bij die personen een mutatie te vinden het grootst is. Els had al op voorhand met haar tante Linda over het erfelijkheidsonderzoek gesproken en ze weet dat haar tante hier zeer positief tegenover staat. Ze besluit een afspraak te maken in de genetische polikliniek, samen met haar tante Linda, zodat het erfelijkheidsonderzoek bij Linda gestart kan worden.
Wanneer ze op de nieuwe afspraak komen, krijgt Linda uitgebreide informatie over het hoe en het waarom van het erfelijkheidsonderzoek en wordt ook stilgestaan bij haar motivatie. De vraag naar medewerking van haar nichtje Els is voor Linda aanvaardbaar. Voordien had ze dit zelf ook al overwogen. Zij bespreekt dit ook in alle openheid met haar kinderen. Ze is wel bezorgd over de mogelijke gevolgen van een ongunstig resultaat. Vooral de idee dat haar kinderen dit ook kunnen hebben overgeërfd vindt ze niet makkelijk. Bovendien blijkt de oudste dochter Hilde al een zware depressieve episode achter de rug te hebben zodat een genetisch onderzoek bij haar niet voor de hand liggend is.
Voor er bij haar bloed afgenomen wordt, ondertekent Linda een formulier waarin ze verklaart voldoende geïnformeerd te zijn over wat dit onderzoek inhoudt en wat de implicaties van de mogelijke resultaten kunnen zijn. Ze is wat verwonderd dat het onderzoek een zestal maanden in beslag zal nemen, maar wanneer de arts haar uitleg geeft over het moleculair onderzoek kan ze hier begrip voor opbrengen.
Een zestal maanden later krijgt Linda een brief thuis waarin ze leest dat het onderzoek is afgewerkt en dat ze op de raadpleging wordt verwacht om het resultaat te bespreken. Els en haar tante besluiten samen naar de raadpleging te komen. Ze krijgen te horen dat, zoals werd verwacht, een afwijking of mutatie in het BRCA1 gen werd gevonden. Linda had de mogelijkheid van dragerschap besproken met haar oncoloog en had al beslist om, indien ze inderdaad draagster zou zijn te kiezen voor een preventief verwijderen van de eierstokken. Preventieve wegname van de borst schrikt haar te zeer af, al blijft de angst voor een nieuwe borsttumor natuurlijk bestaan. Zij kiest ervoor zich goed te laten opvolgen en zo het risico zo klein mogelijk te houden.
Els zelf verwacht dat er onmiddellijk bij haar bloed zal afgenomen worden voor een erfelijkheidsonderzoek. Ze kunnen nu immers bij haar kijken of ze eveneens draagster is. De arts vertelt haar echter dat het beter zou zijn eerst haar vader te onderzoeken. De vader van Els heeft namelijk 50% kans op dragerschap. Als hij de mutatie niet heeft overgeërfd, dan hoeven zijn kinderen niet getest te worden. Els is wat ontgoocheld, maar de mogelijkheid dat haar vader geen drager is, vindt ze een comfortabele gedachte. Ze is ook tevreden dat het onderzoek bij vader nu veel minder lang zal gaan duren: nu de mutatie in het BRCA1 gen is gekend, kan veel sneller bepaald worden of iemand drager is of niet. Haar vader heeft al binnen een viertal weken een afspraak gekregen om zijn resultaat te komen bespreken. Hij blijkt geen drager te zijn. Els is enorm blij met dit resultaat. Het betekent immers dat zij en haar zussen de BRCA1 mutatie niet kunnen overgeërfd hebben en dat hun risico op borstkanker niet hoger is als dat van andere vrouwen van hun leeftijd. Els besluit zich vanaf 50-jarige leeftijd te laten volgen door het mammografisch bevolkingsonderzoek.
Linda’s oudste dochter Hilde weet niet of ze dit onderzoek wel wil laten doen. Ze twijfelt eraan of ze een slecht resultaat zou aankunnen en besluit nog wat af te wachten. Linda’s jongere dochter, Kathleen, is ervan overtuigd dat ze het onderzoek wil laten doen. Ze maakt een afspraak op de polikliniek en krijgt er informatie over de verschillende aspecten van het onderzoek. Ze wordt er ook gezien door een psycholoog. Ze wisselt met hem van gedachten over de redenen waarom ze dit onderzoek wil laten doen en over hoe het resultaat van dit onderzoek haar verdere leven zou kunnen beïnvloeden. Kathleen vertelt dat ze, indien ze draagster is een preventieve borstamputatie met een onmiddellijke reconstructie zal laten uitvoeren. Een wegname van de eierstokken overweegt ze niet onmiddellijk, vooral omdat ze nog zo jong is. Het risico dat ze borstkanker zou ontwikkelen baart haar meer zorgen: ze heeft van nabij het ziekteproces van moeder meegemaakt toen zij chemotherapie kreeg en ze wil dit zelf tegen elke prijs vermijden. Daarnaast spelen haar kinderen een belangrijke rol in haar beslissing: Kathleen wil er altijd voor hen zijn en daarom wil ze de kans dat ze ooit ziek zou worden zo klein mogelijk maken. Na 4 weken komt Kathleen opnieuw op de polikliniek om haar resultaat te kennen. Het onderzoek heeft aangetoond dat ze de mutatie van haar moeder heeft overgeërfd. Na een eerste fase van heftige emoties hervindt ze vrij vlug een zeker evenwicht en put ze vooral kracht uit het feit te weten waar ze aan toe is. Ze vindt het ook geruststellend dat ze steeds op de polikliniek terecht kan bij de arts en de psycholoog als ze bijkomende medische informatie nodig heeft of wanneer het resultaat moeilijker om dragen blijkt.
In de volgende maanden wordt er veel gepraat over de mogelijkheid tot het uitvoeren van een erfelijkheidsonderzoek in de familie. Een aantal personen willen het onderzoek niet laten uitvoeren, anderen, zowel mannen als vrouwen, willen zekerheid en maken een afspraak op de raadpleging. Ook Hilde zet uiteindelijk de stap. Na het vervolledigen van het onderzoek blijkt ze geen draagster te zijn. Ze is enorm gerustgesteld, maar voelt zich toch wat schuldig naar haar zus toe.
